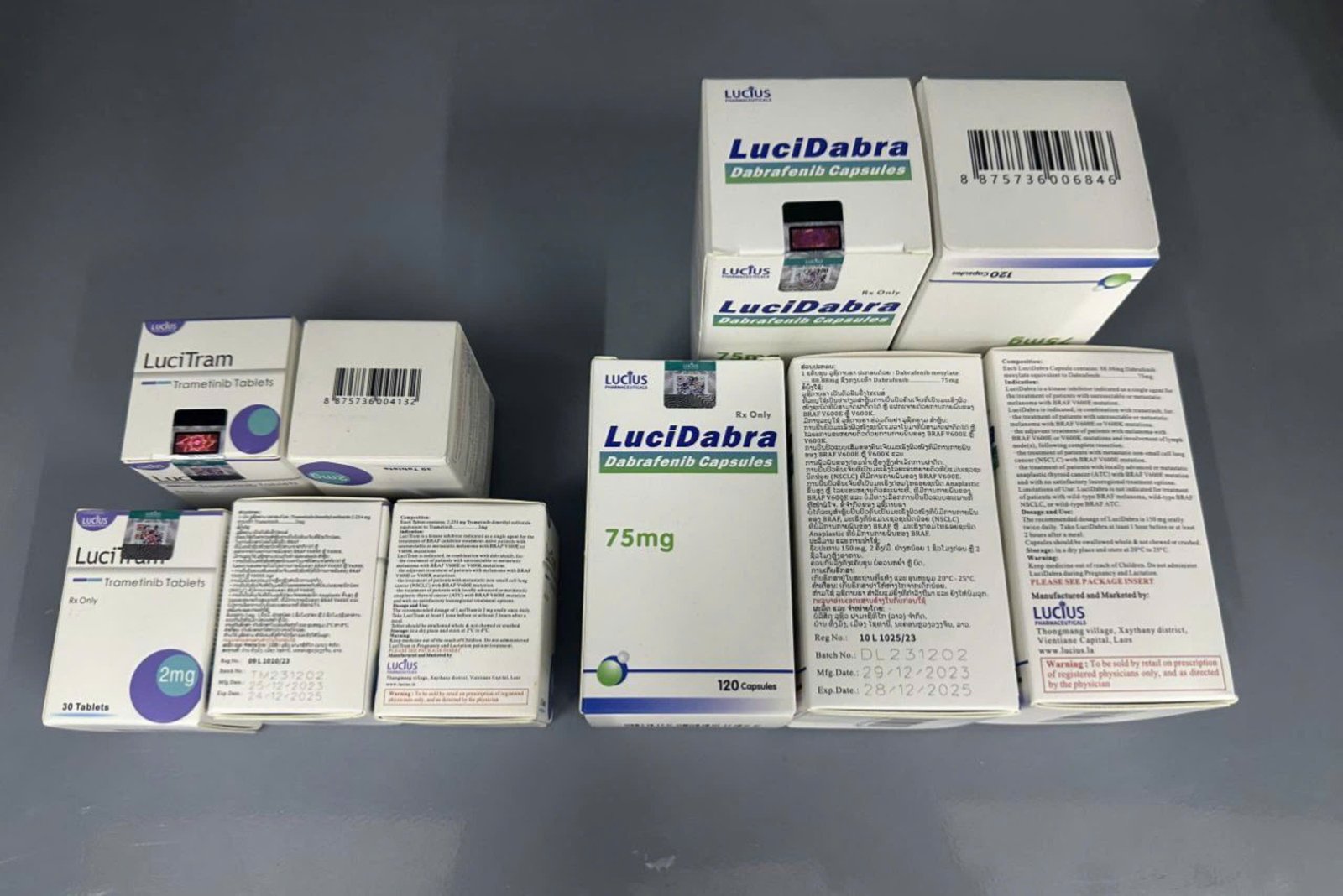
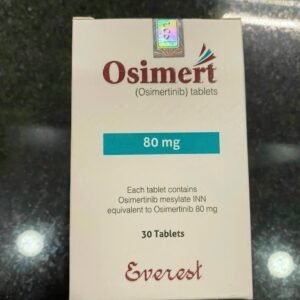
Thuốc Lucitram Trametinib 2mg giá bao nhiêu
Thuốc Lucitram có chứa hoạt chất trametinib là một loại thuốc điều trị ung thư được sử dụng để điều trị cho người lớn có tế bào ung thư có đột biến gen cụ thể (thay đổi) trong gen của họ được gọi là ‘BRAF V600’. Nó được sử dụng để điều trị:
Khối u ác tính (ung thư da) đã lan rộng hoặc không thể phẫu thuật cắt bỏ. Mekinist được sử dụng riêng hoặc kết hợp với một loại thuốc ung thư khác, dabrafenib;
Khối u ác tính tiến triển (giai đoạn III) sau khi phẫu thuật. Mekinist được sử dụng kết hợp với dabrafenib;
Ung thư phổi không tế bào nhỏ tiến triển. Nó được sử dụng kết hợp với dabrafenib.
Khuyến mãi hot nhất:
- Miễn phí giao hàng tận nơi với đơn hàng >500.000VND
- Tư Vấn Dược Sĩ Đại Học: 0778718459
- Đặt hàng: 0778718459
Bạn vui lòng nhập đúng số điện thoại để chúng tôi sẽ gọi xác nhận đơn hàng trước khi giao hàng. Xin cảm ơn!






Đánh giá
Chưa có đánh giá nào.